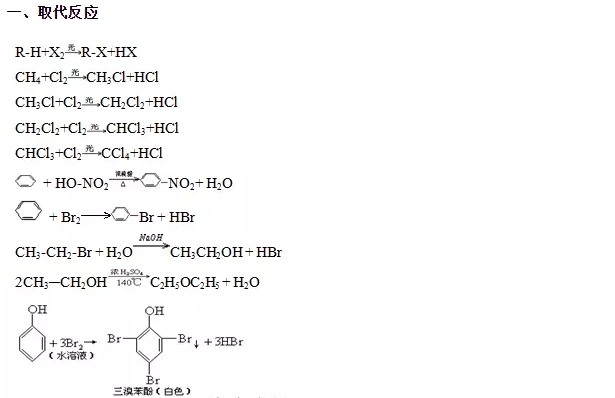
曲线的意义是外面条件(如温度、压强等)对正、逆反应速率影响的变化趋势及变化幅度。图中交点是平衡状况,温度增大后逆反应速率增大得快,平衡向逆向移动;压强增大后正反应速率增大得快,平衡向正向移动。
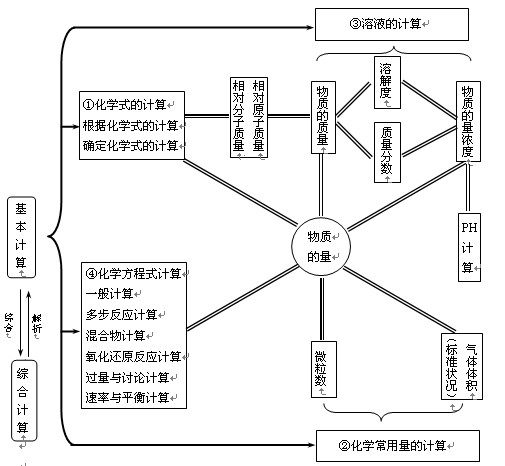
题型二 百分含量(或实际转化的比例)-时间-温度(压强)图像
已知不同温度或压强下,反应物的实际转化的比例(或百分含量)与时间的关系曲线,判断温度的高低及反应的热效应或压强的大小及气体物质间的化学计量数的关系。
[以A(g)+B(g)―C(g)中反应物的实际转化的比例A为例说明]

(1)先拐先平,数值大原则
剖析反应由开始(起始物质相同时)达到平衡所用时间的长短可推知反应条件的变化。
①若为温度变化引起,温度较高时,反应达平衡所需时间短。如甲中T2T1。
②若为压强变化引起,压强较大时,反应达平衡所需时间短。如乙中p1p2。
③若为是不是用催化剂,用适合催化剂时,反应达平衡所需时间短。如图丙中a用催化剂。
(2)反应规律的判断办法
①图甲中,T2T1,升高温度,A减少,平衡逆移,正反应为放热反应。
②图乙中,p1p2,增大压强,A升高,平衡正移,则正反应为气体体积缩小的反应。
③若纵坐标表示A的百分含量,则甲中正反应为吸热反应,乙中正反应为气体体积增大的反应。
题型三 恒温线(或恒压线)图像
已知不同温度下的实际转化的比例-压强图像或不同压强下的实际转化的比例-温度图像,判断反应的热效应或反应前后气体物质间化学计量数的关系。
[以A(g)+B(g)―C(g)中反应物的实际转化的比例A为例说明]

(1)通过剖析相同温度下不同压强时反应物A的实际转化的比例大小来判断平衡移动的方向,从而确定反应方程式中反应物与产物气体物质间的化学计量数的大小关系。如甲中任取一条温度曲线研究,压强增大,A增大,平衡正移,正反应为气体体积减小的反应,乙中任取横坐标一点作横坐标垂直线,也能得出结论。
(2)通过剖析相同压强下不同温度时反应物A的实际转化的比例的大小来判断平衡移动的方向,从而确定反应的热效应。如借助上述剖析办法,在甲中作垂直线,乙中任取一曲线,即能剖析出正反应为放热反应。
题型四 几种特殊图像
(1)对于化学反应mA(g)+nB(g)pC(g)+qD(g),M点前,表示化学反应从反应物开始,则v正 v逆;M点为刚达到的平衡点。M点后为平衡受温度的影响状况,即升温,A%增大(C%减小),平衡左移,H0。
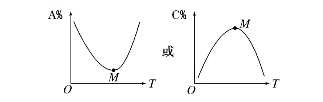
(2)对于化学反应mA(g)+nB(g)pC(g)+qD(g),L线上所有些点都是平衡点。

左上方(E点),A%大于此压强时平衡体系中的A%,E点需要朝正反应方向移动才能达到平衡状况,所以,E点v正v逆;则右下方(F点)v正v逆。